|
Các
phản ứng hóa học xảy ra trong tế bào
sống được tăng tốc nhờ những
chất xúc tác sinh học,
được gọi là enzym, và thường là các
protein. Một tế bào
động vật, có thể chứa đến 4.000
loại enzym khác nhau; mỗi loại xúc tác cho một
phản ứng hóa học khác nhau.
Một số enzym chung cho nhiều loại tế bào,
trong khi một số khác chỉ chuyên biệt cho
một loại tế bào để thực hiện
một chức năng đặc biệt.
Trong một phản ứng có enzym, chất phản
ứng được gọi là cơ chất (substrate).
Hầu hết enzym có tính chuyên biệt và chỉ
phản ứng một cách chọn lọc trên một
loại cơ chất nào đó mà thôi.
Là chất xúc tác, enzym giảm năng lượng
kích động cần thiết cho một phản
ứng xảy ra trong điều kiện nhiệt độ
và sinh lý bình thường (thí dụ 37°C ở hầu
hết hữu nhũ).
Enzym
có thể mang hai chất lại với nhau nhờ
tạo ra sự phối hợp tạm thời giữa các
cơ chất hay tập trung vào một cầu nối
hoa học đặc biệt trên cơ chất (Hình 35).
Tất cả enzym được dùng đi dùng
lại.
Enzym có khả năng xúc tác siêu tốc.
Thí dụ, phản ứng giữa CO2
+ H2O tạo ra H2 CO3 phản ứng xảy ra rất
chậm, có thể chỉ tạo ra 200 phân tử acid
carbonic/1 giờ khi không có enzym.
Trong tế bào sống, phản ứng được
xúc tác với enzym carbonic anhydraz ước chừng có
600.000 phân tử acid carbonic/1 giây.
Phản ứng nhanh gấp 10 triệu lần.
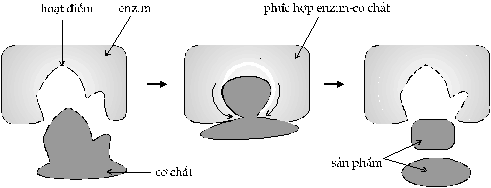
Trong cấu trúc không gian ba chiều, sợi
polypeptid của enzym cuộn lại tạo ra một hay
nhiều rảnh trên bề mặt, là những vùng
đặc biệt mà cơ chất có thể gắn vào.
Vùng này được gọi là hoạt điểm
(active site) (Hình 35). Hoạt
điểm của mỗi enzym có hình dạng đặc
biệt và chỉ có một loại phân tử cơ
chất có thể gắn vào.
Hoạt điểm
không những là nơi cơ chất gắn vào mà hướng
cơ chất theo một hướng nhất định.
Hoạt điểm có thể phân cực hay không,
ưa nước hay kỵ nước nên nó gắn
một cách chính xác vào phần nào của cơ
chất. Thí dụ
nếu ở phần phân tử cơ chất có điện
tích dương thì hoạt điểm của enzym
sẽ có điện tích âm.
Hoạt điểm của enzym chỉ gồm vài
acid amin của toàn thể enzym, những acid amin này
kề cận nhau trong một chuỗi polypeptid hay ở
những phần khác nhau của các chuỗi polypeptid nhưng
kề cận nhau do sự cuộn lại tạo ra
cấu trúc không gian ba chiều cấp ba và cấp
bốn của enzym. Gốc
R của acid amin được đưa ra ngoài tạo
ra hoạt điểm và cách sắp xếp của chúng
quyết định sự gắn cơ chất với
enzym.
Hình
35. Mô hình cơ chế xúc tác của
enzym
* Mô hình hoạt động của enzym +
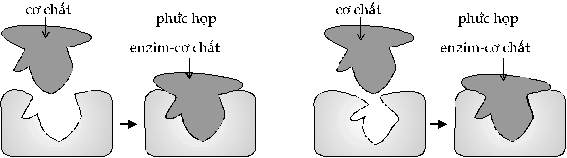
Mô hình ổ và chìa khóa (Hình
36) Theo
thuyết này, một cơ chất gắn vào hoạt
đểm như một chìa khóa gắn khít vào ổ,
cơ chất và enzym gắn vào nhau tạo ra một
phức hợp enzym-cơ chất.
Cơ chất bị
Mô hình ổ và chìa khóa
Mô hình
cảm ứng +
Mô hình cảm ứng (the induced-fit model) (Hình 37) Các
nghiên cứu cấu trúc của enzym cho rằng hoạt
điểm linh động hơn lỗ của ổ khóa.
Trong một số trường hợp, trong lúc cơ
chất gắn vào, cấu hình thay đổi do hình
dạng hoạt điểm của enzym bị cảm
ứng làm cho chúng khớp với nhau hơn.
Sự cảm ứng này làm thay đổi lực
giữa các nối đặc biệt của phân tử
phản ứng do đó phản ứng có xúc tác
được dễ dàng xảy ra.
* Các yếu tố ảnh hưởng lên hoạt động của enzym +
pH có thể làm thay đổi cấu hình của enzym,
đặc biệt là sự tương tác giữa
những acid amin có điện tích âm (acidic) và điện
tích dương (basic). Khi
pH thay đổi, hình dạng của hoạt điểm
có thể thay đổi, do đó cơ chất không
thể gắn vào được.
Hầu hết enzym hoạt động tốt
nhất trong khoảng pH 6 - 8.
Tuy nhiên, pepsin giúp tiêu hóa protein
trong bao tử hoạt động trong khoảng pH
rất thấp (2). Pepsin
có một trình tự acid amin duy trì cầu nối hydro và
ion hóa ngay cả khi có sự hiện diện của acid
mạnh. pH cũng
ảnh hưởng trên phản ứng trong đó ion H+
là một thành phần của sự thay đổi hóa
học đượcû xúc tác.
+ Nhiệt độ thay đổi dễ làm đứt
các cầu nối hydro, các cầu nối này và sự tương
tác giữa các cực kỵ nước giúp giữ
cấu trúc cấp ba, cấp bốn của protein kể
cả enzym. Sinh vật
thường có những enzym hoạt động tối
ưu ở nhiệt độ mà chúng sống.
Ở hữu nhũ, nhiệt độ tối
ưu từ 35 - 40°C. Dưới
nhiệt độ này, các nối để giữ hình
dạng của protein không đủ linh động
để thay đổi hình dạng cần thiết
tham gia phản ứng. Do
đó, enzym hoạt động không hữu hiệu
ở nhiệt độ dưới 35°C. Trên
40°C, các cầu nối hydro và các cầu nối yếu
khác không thể giữ protein ở
hình dạng chính xác của nó.
Một enzym bị biến tính một phần
bởi nhiệt có cấu trúc bị quéo lại một
chút và chuỗi polypeptid thay đổi cấu hình
(conformation) có thể trở lại hình dạng cũ
nếu được làm nguội, nhưng nếu
biến tính hoàn toàn như albumin của trứng
luộc chín thì không thể trở lại dạng ban
đầu được nữa.
* Cofactor và coenzym Nhiều enzym cần phải có thêm các thành phần hóa học khác để thực hiện chức năng, phần thêm đó được gọi là cofactor. Cofactor có thể la một phân tử hữu cơ hay các ion kim loại (sắt, mangan, kẽm...). Khi cofactor là một phân tử hữu cơ không phải là protein, như một vitamin, thì được gọi là coenzym. Tương tự enzym, coenzym cũng được sử dụng lại sau khi xúc tác phản ứng. Dù cần với một lượng rất nhỏ nhưng nếu thiếu coenzym thì rất tai hại đối với đời sống sinh vật, cho nên trong khẩu phần cần phải có vitamin. Coenzym và cofactor được tìm thấy ở các enzym trong các chuỗi dẫn truyền điện tử của các quá trình quang hợp và hô hấp của tế bào.
|