
Ưu
điểm của phương pháp động
học phân tử là đi sâu vào bản chất
hiện tượng nhưng nó cũng gặp
phải những nhược điểm như tính
chất gần đúng của những kết
quả định lượng và sự phức
tạp của công việc tính toán. Phương
pháp nhiệt động lực học không
khảo sát chi tiết hiện tượng xảy
ra mà chỉ tính sự biến đổi năng
lượng trong những hiện tượng
ấy. Phương pháp này được phát
sinh từ sự khảo sát sự biến đổi
nhiệt năng thành cơ năng để
chạy các máy phát động lực như máy
hơi nước, máy nổ chạy bằng ét xăng,
nên có tên gọi là phương pháp nhiệt
động lực học. Các nguyên lý nhiệt
động lực học này rất cần
thiết cho kỹ thuật cũng như cho
việc nghiên cứu khoa học nói chung.
| I.
TRẠNG THÁI CÂN BẰNG VÀ CÁC QUÁ TRÌNH
NHIỆT ÐỘNG LỰC HỌC.
|
|
|
1.
Trạng thái cân bằng
|

|
Trong
cơ học, ta biết rằng trạng thái cân
bằng của một vật là trạng thái mà
vật đó đứng yên đối với
một hệ quy chiếu quán tính nhất định.
Trong
nhiệt động lực học khái niệm
trạng thái cân bằng của một hệ là
trạng thái trong đó các đại lượng
vĩ mô (p, V, T) xác định trạng thái
của hệ là không thay đổi. Những
đại lượng xác định trạng thái
của một vật còn gọi là thông số
trạng thái.
Ở
trạng thái cân bằng nhiệt động
lực học không thể xảy ra các hiện tượng
truyền nhiệt, các phản ứng hóa học,
biến đổi trạng thái giữa khí,
lỏng, rắn. Trạng thái cân bằng nhiệt
động lực học khác với trạng thái
cân bằng cơ học ở chỗ là mặc dù
các đại lượng vĩ mô đặc trưng
cho hệ không đổi nhưng các phần
tử cấu tạo nên hệ vẫn không
ngừng chuyển động hỗn loạn.
Chẳng hạn một hệ gồm một
chất lỏng, đựng trong bình kín, trên
mặt của chất lỏng có hơi bão hoà
của nó. Hệ này ở trạng thái cân
bằng nên các đại lượng p, V, T là không
đổi. Tuy nhiên bên trong hệ vẫn có
những phân tử bay hơi ra khỏi chất
lỏng và ngược lại cũng có những
phân tử thuộc phần hơi bão hoà bay
trở lại vào chất lỏng. Dĩ nhiên
số phân tử bay ra và bay trở vào chất
lỏng trong cùng một thời gian nào đấy
phải bằng nhau.
Chất
khí ở trạng thái cân bằng thì nhiệt
độ của nó tại mọi điểm
của nó đều
giống nhau và không đổi theo thời gian. Tuy
nhiên tại một miền nhỏ nào đó trong
không gian và ở một thời điểm
nhất định nào đấy, các phân tử
chất khí có thể có động năng trung bình
lớn hơn động năng trung bình các phân
tử chất khí ở những miền khác. Do
đó nhiệt độ ở miền nhỏ nói
trên có thể lớn hơn nhiệt độ
ở các miền khác. Như vậy, sẽ
xảy ra sự dẫn nhiệt từ miền có
nhiệt độ cao đến miền có
nhiệt độ thấp. Sự dẫn nhiệt
này chỉ có thể xảy ra trong một phạm
vi không gian nhỏ so với toàn bộ thể tích
chất khí.
Hình
(10.1) biểu diễn sự phụ thuộc
của áp suất chất khí ở trạng thái cân
bằng theo thời gian. Ta thấy tuy rằng
chất khí được giữ ở trạng
thái cân bằng nhưng giá trị áp suất không
phải hoàn toàn bất biến mà dao động
ít nhiều chung quanh giá trị trung bình. Những
dao động nhỏ như vậy được
gọi là những thăng giáng.
Như
vậy có hai đặc điểm của
trạng thái cân bằng nhiệt động
lực học.

Cuối
cùng ta cần phân biệt trạng thái cân
bằng và trạng thái dừng. Giả sử có
một thanh kim loại mà hai đầu thanh
được giữ ở hai nhiệt độ
xác định và khác nhau. Ta nói rằng trong thanh
kim loại có trạng thái dừng chứ không có
trạng thái cân bằng vì rằng bên trong thanh
kim loại đã xảy ra quá trình truyền
nhiệt (vĩ mô) từ phần có nhiệt độ
cao hơn đến nhiệt độ thấp hơn.
Trạng thái dừng có liên quan đến
sự cung cấp nhiệt ổn định
từ các nguồn.
Vậy
có thể rút ra một định nghĩa đầy
đủ hơn về trạng thái cân bằng
nhiệt động lực học . Ðó là
trạng thái của một hệ mà các thông
số trạng thái của hệ không thay đổi
và trạng thái của hệ không thay đổi,
trong hệ không xảy ra các quá trình như
dẫn nhiệt, khuếch tán, phản ứng hóa
học, chuyển pha.v.v...
|
2. Quá trình chuẩn cân bằng
|

|
Khi một hệ biến đổi từ
trạng thái này sang trạng thái khác, một
chuổi các trạng thái nối tiếp nhau
xảy ra, tạo nên một quá trình. Những
trạng thái nối tiếp nhau này là những
trạng thái cân bằng vì sự biến thiên
của các thông số trạng thái theo thời
gian là đủ chậm so với khoảng
thời gian giữa hai trạng thái kế tiếp
được chọn tuỳ ý .Một quá trình
diễn biến vô cùng chậm như thế
được gọi là quá trình chuẩn cân
bằng (chuẩn tĩnh) và có thể coi nó là
một dãy nối tiếp các trạng thái cân
bằng.
Những
quá trình xảy ra trong thực tế không phải
là những quá trình chuẩn cân bằng nhưng
nếu chúng xảy ra càng chậm bao nhiêu thì càng
gần đúng là quá trình chuẩn cân bằng
bấy nhiêu.

|
3. Quá trình thuận nghịch
|

|
Trong
nhiệt động lực học, không những
chúng ta chỉ xét quá trình nói chung mà ta cần chú
ý đến cả chiều diễn biến
của quá trình. Vì thế dưới đây ta
sẽ xét khái niệm quá trình thuận nghịch.
Quá
trình thuận nghịch là quá trình diễn
biến theo cả hai chiều, trong đó nếu lúc
đầu quá trình diễn ra theo một chiều
nào đó (chiều thuận) rồi sau lại
diễn ra theo chiều ngược lại để
trở về trạng thái ban đầu thì
hệ đi qua mọi trạng thái giống như
lúc hệ diễn biến theo chiều thuận và
khi hệ đã trở về trạng thái ban
đầu thì không gây ra một biến đổi
gì cho ngoại vi.
Mọi quá trình thuận nghịch đều
là quá trình chuẩn cân bằng. Ta có thể
biểu diễn quá trình thuận nghịch trên
đồ thị bằng một đường
cong liền nét như đối với quá trình
chuẩn cân bằng.
Mọi
quá trình thực do diễn biến nhanh hoặc vì
bao giờ cũng có sự tỏa nhiệt do ma sát
nên chúng đều không phải là quá trình
thuận nghịch. Trong trường hợp này khi
hệ trở lại trạng thái ban đầu thì
quá trình đã gây ra một sự biến đổi
cho ngoại vi và quá trình bao gồm một dãy các
trạng thái không cân bằng. Những quá trình này
gọi là quá trình không thuận nghịch. Nếu
chúng xảy ra càng chậm và càng ít ma sát thì chúng
càng gần đúng với quá trình thuận
nghịch và các qúa trình đó
đều là những quá trình đã
được lý
tưởng hóa .
Nhiệt
động lực học nghiên cứu sự
biến đổi năng lượng trong quá trình
chuẩn cân bằng tức là những quá trình
thuận nghịch. Những quá trình này được
gọi chung là quá trình nhiệt động
lực học.
| II.
NĂNG LƯỢNG CHUYỂN ÐỘNG
NHIỆT VÀ NỘI NĂNG CỦA KHÍ LÝ TƯỞNG
|
|
|
1.
Ðịnh luật phân bố đều năng
lượng Boltzmann.
|
TOP
|
Năng
lượng chuyển động nhiệt còn
gọi là nhiệt năng của một vật nào
đó chính là tổng năng lượng
chuyển động của tất cả các phân
tử cấu tạo nên vật. Việc xét riêng
nhiệt năng và sự biến đổi
của nó trong một vật là rất khó khăn
bởi vì năng lượng chuyển động
nhiệt của các phân tử luôn luôn liên quan
mật thiết với thế năng tương
tác giữa các phân tử. Chẳng hạn khi
đung nóng vật, nhiệt độ của nó tăng
lên thì không những năng lượng chuyển
động mà cả thế năng của các phân
tử cấu tạo nên vật cũng đều
biến đổi. Vì vậy, để thuận
tiện cho việc tìm hiểu sâu về năng lượng
chuyển động nhiệt ta chọn khí lý tưởng
trong đó lực tương tác và do đó
thế năng tương tác giữa các phân
tử rất nhỏ, có thể bỏ qua.
Ðối
với các khí một nguyên tử (ví dụ như
Hêli, Nêon, Argon) ta có thể coi phân tử như
là chất điểm. Phân tử có 1 nguyên
tử chỉ có động năng của
chuyển động tịnh tiến còn động
năng ứng với chuyển động quay thì
không có. Nguyên tử gồm một hạt nhân
tập trung hầu hết khối lượng nguyên
tử và một vành nhẹ của các electron. Khi
các phân tử va chạm nhau thì ngoài việc trao
đổi cho nhau động năng của
chuyển động tịnh tiến phân tử,
phân tử này còn truyền cho vành electron của
phân tử kia một xung lượng quay. Nhưng
xung lượng này không làm quay được
hạt nhân vì giữa hạt nhân và vành electron không
có sự liên kết rắn chắc. Hơn
nữa vì mômen quán tính I của chuyển động
quay của phân tử có 1 nguyên tử nhỏ có
thể coi bằng không (vì bán kính hạt nhân quá
nhỏ) do đó động năng của
chuyển động quay phân tử cũng coi như
bằng không, nghiã là cho rằng nguyên tử không
quay.
Vậy
đối với khí lý tưởng một nguyên
tử chứa N
phân tử thì năng lượng chuyển động
nhiệt của nó sẽ là:

Sự
phân bố động năng của phân tử
một nguyên tử thành 3 thành phần độc
lập liên quan tới việc coi phân tử như
một chất điểm có 3 bậc tự do. Ta
nhớ rằng số bậc tự do của
một cơ hệ là số toạ độ
độc lập cần thiết để xác
định vị trí và cấu hình của cơ
hệ đó trong không gian.
Từ
nhận xét trên ta suy ra rằng đối với
mỗi bậc tự do, động năng trung bình
của chuyển động tịnh tiến
của phân tử có 1 nguyên tử là
bằng nhau và bằng KT/2
Từ
đó, một cách tự nhiên, người ta
giả thiết rằng nếu như phân tử còn
có thêm một số bậc tự do khác thì đối
với mỗi bậc tự do này cũng sẽ có
thành phần động năng trung bình là KT/2.
Trong
phạm vi vật lý cổ điển lý
thuyết trên đã được chứng minh và
được phát biểu một cách đầy
đủ như sau: Nếu
hệ phân tử ở trạng thái cân bằng
với nhiệt độ T thì động năng
trung bình phân bố đều theo bậc tự do
và ứng với mỗi bậc tự do của phân
tử thì động năng trung bình là KT/2 . Ðó
là định luật của sự phân bố
đều động năng theo bậc tự do
hay gọi tắt là định luật phân
bố đều năng lượng Boltzmann.
|
2.
Năng lượng chuyển động
nhiệt của chất khí mà phân tử
gồm nhiều nguyên tử.
|

|
Trước
hết ta xét phân tử có 2 nguyên tử. Phân
tử này có thể coi như một hệ
gồm 2 nguyên tử cách nhau một khoảng nào
đó (Hình 10.3). Giả sử khoảng cách
giữa hai nguyên tử không đổi (trường
hợp này phân tử được coi là phân
tử "rắn chắc") .Một hệ như
vậy, nói chung, có 6 bậc tự do.

Tóm
lại đối với phân tử 2 nguyên tử
"rắn chắc" (như H2, O2, N2 v.v...) thì
số bậc tự do bằng 5 trong đó 3
bậc tự do ứng với chuyển động
tịnh tiến (quy ước gọi tắt là
bậc tự do tịnh tiến) và 2 bậc
tự do ứng với chuyển động quay
(quy ước gọi tắt là bậc tự do
quay). Vậy động năng trung bình của phân
tử 2 nguyên tử là:
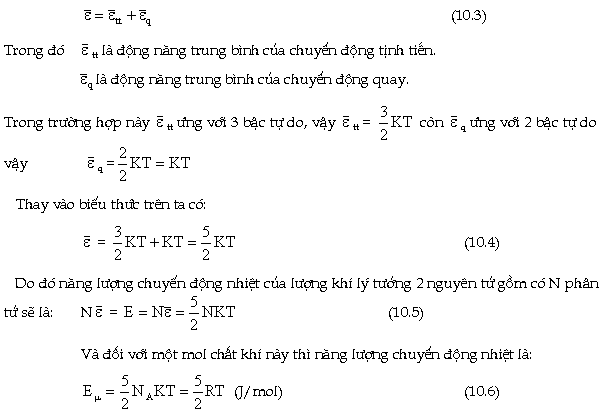
Ðối với phân tử có 3 hay nhiều
nguyên tử liên kết rắn chắc với nhau
(như H2O, NH3 v.v...) thì có 3 bậc tự do
tịnh tiến và 3 bậc tự do quay, trừ trường
hợp các nguyên tử nằm trên cùng đường
thẳng, khi đó số bậc tự do quay
chỉ có 2 (giống như đối với phân
tử có 2 nguyên tử). Hình vẽ 10.4
nêu thí dụ đối với phân tử 3
nguyên tử rắn chắc. Vậy năng lượng
chuyển động nhiệt của lượng
khí lý tưởng 3 hay nhiều nguyên tử
gồm N phân tử sẽ là :
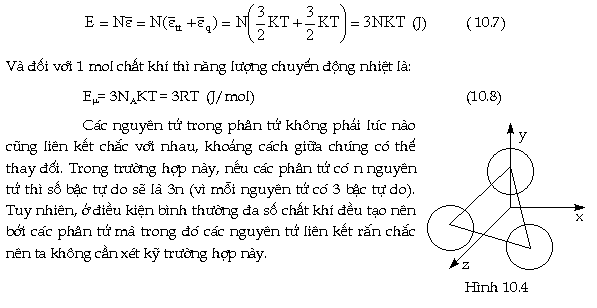
Cần
chú ý rằng ở nhiệt độ bình thường
các nguyên tử trong phân tử coi như không dao
động. Nhưng ở nhiệt độ đủ
cao, các nguyên tử sẽ dao động chung quanh
vị trí cân bằng. Dao động này được
coi như dao động điều hoà. Cơ
học đã cho biết, giá trị trung bình
của động năng và thế năng
của dao động điều hoà bằng nhau.
Vì vậy nếu trong phân tử mà các nguyên
tử dao động điều hoà thì theo định
luật phân bố đều năng lượng,
năng lượng ứng với mỗi bậc
tự do dao động sẽ gồm 2 phần:
một phần năng lượng dưới
dạng động năng có giá trị bằngĠ,
một phần năng lượng dưới
dạng thế năng có giá trị cũng
bằng KT/2 . Như
vậy năng lượng ứng với 1 bậc
tự do dao động không phải là KT/2
mà là
KT/2 . Từ
đó suy ra về phương diện phân bố
năng lượng thì một bậc tự do dao
động tương đương với 2
bậc tự do tịnh tiến hoặc quay.

Ðể
đi đến một công thức tổng quát
cho năng lượng chuyển động
nhiệt của khí lý tưởng, ta gọi i là
số bậc tự do của một phân tử.
Mỗi bậc tự
do ở đây tương đương với
một bậc tự do dao động thì trong khi tính
tổng số bậc tự do toàn bộ của
phân tử i ,ta đổi mỗi bậc tự do
dao động thành 2 bậc tự do tịnh
tiến hay quay. Vậy năng lượng trung bình
của một phân tử chuyển động
được biểu thị bằng công
thức:

Từ
đó suy ra năng lượng chuyển động
của một mol chất khí lý tưởng
sẽ có công thức tổng quát là:

Lý
thuyết về năng lượng chuyển động
nhiệt trình bày trên chỉ có tính chất
gần đúng và chỉ ứng dụng được
đối với chất khí ở điều
kiện bình thường. 
Năng
lượng chuyển động nhiệt trong
một vật là một thành phần của
nội năng của vật ấy. Nội năng
của một vật gồm toàn bộ các
dạng năng lượng trong vật gồm năng
lượng chuyển động nhiệt, thế
năng tương tác giữa các phân tử,
thế năng tương tác giữa các nguyên
tử trong từng phân tử, động năng
và thế năng tương tác của các
hạt cấu tạo nên nguyên tử (hạt nhân
và các electron) v.v... Tất cả các dạng năng
lượng trừ 2 dạng năng lượng
đầu tiên gọi chung là năng lượng
bên trong các phân tử.
Ðối
với 1 mol vật chất ta gọi.


| III.
SỰ LIÊN QUAN GIỮA NHIỆT LƯỢNG
VÀ CÔNG CƠ HỌC.
|
TOP
|
Từ
công thức (10.15) ta thấy khi nhiệt độ
của khí lý tưởng thay đổi thì
nội năng của khí cũng thay đổi.
Vậy ta có thể làm thay đổi nội năng
của khí bằng sự trao đổi nhiệt lượng
giữa khí với ngoại vật. Phần năng
lượng chuyển động nhiệt đã
được truyền từ ì vật này đến
vật khác gọi là nhiệt lượng.
Ta
có thể làm thay đổi nhiệt độ
của khí bằng cách thực hiện công cơ
học. Chẳng hạn, để làm nóng khí lên,
ta dùng tay nén khi một cách đột ngột. Ngược
lại để làm khí lạnh đi, ta để
cho khí tự dãn ra đột ngột và khí
sẽ thực hiện công cơ học.
Vậy
sự truyền năng lượng nói chung
được thực hiện dưới hai hình
thức khác nhau. Ðó là sự truyền nhiệt lượng
và sự thực hiện công cơ học. Sự
truyền nhiệt lượng là hình thức
truyền năng lượng xảy ra trực
tiếp giữa những nguyên tử hay phân
tử chuyển động hỗn loạn cấu
tạo nên các vật đang tương tác; còn
sự thực hiện công là hình thức
truyền năng lượng giữa những
vật vĩ mô tương tác với nhau .
Căn
cứ vào bản chất vật lý của
nhiệt lượng và công cơ học như
đã nêu ở trên thì hai đại lượng
này phải đo bằng cùng đơn vị.
Trong hệ SI đơn vị đo nhiệt lượng
cũng giống như đơn vị đo công
cơ học. Ðó là Joule (J). Nhưng trong quá trình
phát triển của vật lý học, lúc đầu
chưa hiểu được bản chất
của các hiện tượng nhiệt, nên
dựa vào thuyết "chất nhiệt" người
ta đã quy ước đo nhiệt lượng
bằng calo (viết tắt là cal) tức là
nhiệt lượng để làm nóng một gam
(g) nước ở áp suất chuẩn (p = 760
mmHg) từ 19,5oC đến 20,5oC.
Ðơn
vị nhiệt lượng còn có thể chọn
là kcal: 1 kcal = 1000
cal.
Khoảng
giữa thế kỷ 19, Joule đã chứng minh
bằng thực nghiệm mối liên quan định
lượng giữa đơn vị J và
đơn vị cal.
1 cal = 4,18 J.
Ðể
biểu thị mối liên quan này, ta định
nghĩa đương lượng công của
nhiệt là:
I = 4.18 J/cal.
(10.16)
Và
đương lượng nhiệt của công là

Nhiệt
lượng và công cơ học tuy cùng đơn
vị nhưng sự truyền nhiệt lượng
và sự thực hiện công là hai hình thức
truyền năng lượng khác nhau, nên chúng có
những điểm khác nhau về mặt định
tính. Sự truyền nhiệt cho hệ là sự
truyền năng lượng của chuyển
động hỗn loạn của các phân tử
từ nơi này đến nơi khác và
trực tiếp dẫn đến sự tăng
nội năng của hệ. Ngược lại,
sự thực hiện công lên hệ thì có
thể là sự truyền của cùng một
dạng năng lượng bất kỳ nào đó
không phải là nhiệt năng từ nơi này
đến nơi khác. Cũng có thể là sự
biến đổi giữa những dạng năng
lượng khác nhau, trực tiếp dẫn đến
sự tăng một dạng năng lượng
bất kỳ của hệ (động năng,
thế năng, nội năng,...)
Bây
giờ ta hãy phân tích sự khác nhau giữa năng
lượng với nhiệt lượng và công.
Ta
đã biết rằng năng lượng là đại
lượng đặc trưng cho sự chuyển
động và tương tác của vật
chất. Chẳng hạn cơ năng đặc
trưng cho chuyển động động cơ
học, nhiệt năng đặc trưng cho
chuyển động hỗn loạn của các phân
tử, điện năng đặc trưng cho
chuyển động của các hạt mang điện,
thế năng hấp dẫn đặc trưng
cho tương tác hấp dẫn giữa các
vật thể, thế năng của điện
trường đặc trưng cho sự tương
tác điện giữa các vật mang điện
v.v...
Vậy
ta thấy nhiệt lượng và công không
phải là những dạng năng lượng mà
chỉ là những phần năng lượng
đã được trao đổi giữa các
vật tương tác với nhau khi có sự thay
đổi trạng thái . Nhiệt và công chỉ
xuất hiện khi có sự truyền hoặc
biến đổi năng lượng còn năng
lượng thì luôn luôn tồn tại cùng
vật chất.
Trong
phần nầy ta sẽ gặp nhiều lần khái
niệm "biến nhiệt thành công" (hay ngược
lại). Ta không thể giải thích đó là
sự biến đổi nhiệt năng thành cơ
năng vì giải thích như vậy là thiếu
chính xác. Ta cần hiểu rằng đó là
sự biến đổi cách truyền năng lượng
dưới hình thức nhiệt công. Ðể làm sáng
tỏ vấn đề, ta hãy dẫn ra thí dụ
sau. Khi đun nóng khí trong một xylanh có pit-tông,
ta đã truyền một phần năng lượng
chuyển động nhiệt từ chất đốt
ở nhiệt độ cao cho chất khí nạp
vào xylanh từ bên ngoài, nghĩa là có sự
truyền năng lượng dưới hình
thức nhiệt. Sau
đó nội năng của hệ khí tăng lên
và sẽ được truyền một phần
thành cơ năng cho pit-tông (khí trong xylanh đẩy
pit-tông) và phần khác được truyền thành
nhiệt năng làm nóng
cho vỏ xylanh và pit-tông (do sự ma sát
giữa pit-tông và xylanh).
Tất
cả sự biến đổi năng lượng
này đều xảy ra dưới hình thức công.
Kết quả của hai quá trình trên được
gọi là sự biến nhiệt thành công. Rõ ràng
ở đây không có sự biến đổi
trực tiếp nào từ chuyển động
nhiệt của các phân tử sang chuyển động
của pit-tông mà phải đi qua khâu trung gian là
từ việc dùng nhiệt của nhiên liệu làm
tăng nội năng và từ nội năng sang
cơ năng. Ta có thể tóm tắt những
nhận xét trên bằng sơ đồ sau:

Sau
này khi nghiên cứu nguyên lý 2 nhiệt động
lực học ta sẽ thấy rõ ràng không bao
giờ có thể biến đổi trực
tiếp nhiệt năng thành cơ năng nhưng
ngược lại ta có thể biến đổi
trực tiếp cơ năng thành nhiệt năng
(ví dụ cọ sát 2 bàn tay vào nhau).
| IV.
NGUYÊN LÝ THỨ NHẤT CỦA
NHIỆT ÐỘNG LỰC HỌC.
|
|
|
1.
Nguyên lý bảo toàn và biến hóa năng lượng
|

|
Nguyên
lý bảo toàn và biến hóa năng lượng nóïi
rằng: "Ở những quá trình khác nhau
diễn ra trong tự nhiên, năng lượng không
sinh ra từ hư vô cũng không biến mất mà
chỉ biến hóa từ dạng này sang dạng
khác".
Nguyên
lý thứ nhất của nhiệt động
lực học chính là nguyên lý bảo toàn và
biến hóa năng lượng áp dụng trong các
quá trình có liên quan đến sự biến đổi
nội năng sang cơ năng và nhiệt năng
hoặc sang các dạng năng lượng khác và
ngược lại.
|
2. Nội năng là một hàm số
đơn giá của trạng thái.
|

|
Từ
nguyên lý bảo toàn và biến hóa năng lượng
có thể chứng minh rằng: Nội năng là
một hàm số đơn giá của trạng thái
nghĩa là ứng với mỗi trạng thái xác
định (p, V, T) chỉ có một gía trị
nội năng duy nhất.
Thật
vậy, nếu ở một trạng thái hệ có
nhiều giá trị khác nhau của nội năng
thì chúng ta có thể khai thác phần năng lượng
khác nhau đó mà hệ vẫn không thay đổi
gì cả (vì trạng thái không đổi) như
vậy có nghĩa là chúng ta thu được năng
lượng từ hư vô. Ðiều đó trái
với định luật bảo toàn và biến
hóa năng lượng.
|
3. Nguyên lý thứ nhất của nhiệt
động lực học
|

|
Bây
giờ ta hãy khảo sát trường hợp
hệ biến đổi từ trạng thái (1)
đến trạng thái (2) chỉ do sự trao
đổi nhiệt giữa hệ với ngoại
vật và sự thực hiện công của
ngoại vật đối với hệ.

Nếu
do sự trao đổi nhiệt và thực
hiện công của ngoại vật lên hệ mà
hệ chuyển từ một trạng thái xác
định nầy sang một trạng thái xác
định khác, thì trong mọi cách chuyển có
thể xảy ra giữa hai trạng thái đó,
tổng nhiệt lượng trao đổi và công
thực hiện là không đổi.
Trong
trường hợp hệ thực hiện một
quá trình kín (chu trình) nghĩa là sau quá trình
biến đổi trạng thái hệ lại quay
trở về đúng trạng thái ban đầu
thì ta có:

Từ
đấy ta rút ra cách phát biểu nguyên lý
thứ nhất cho một chu trình là:
Nếu
hệ biến đổi trạng thái theo một
chu trình bất kỳ nào đó có thể xảy
ra thì tổng
nhiệt lượng trao đổi và công
thực hiện trong chu trình đó phải
bằng không, nội năng của hệ không
đổi.

Hệ
thức này nói lên rằng giá trị nội năng
của một trạng thái của hệ
được xác định sai khác một
hằng số cộng.
Quá
trình thiết lập nguyên lý thứ nhất có liên
quan chặt chẽ với một vấn đề
hấp dẫn trong lịch sử vật lý là có
thể thực hiện được động
cơ vĩnh cửu loại 1 hay không ? Ðộng cơ
vĩnh cửu loại 1đó là loại động
cơ có thể sinh công mà không cần tiêu
thụ năng lượng nào cả hoặc
chỉ tiêu thụ một phần năng lượng
ít hơn là công sinh ra. Một động cơ như
vậy không thể nào thực hiện được.

Biểu
thức giải tích của nguyên lý thứ
nhất.
Với
một biến đổi rất nhỏ của
trạng thái của hệ, ta viết
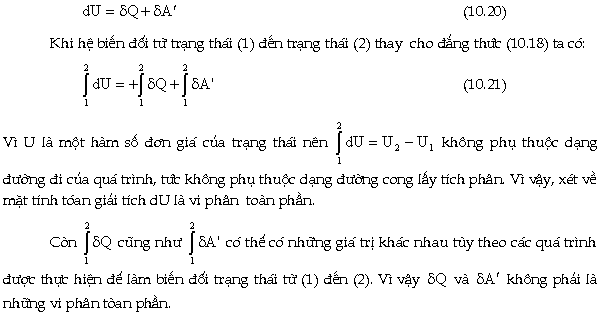
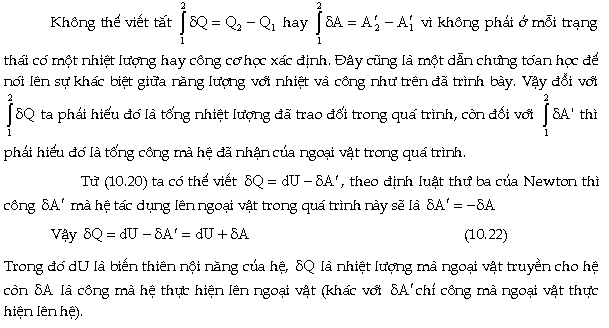
Biểu
thức (10.22) là nội dung của nguyên lý
thứ nhất. Khi vận dụng nó để xét
các vấn đề cụ thể ta quy ước
như sau:
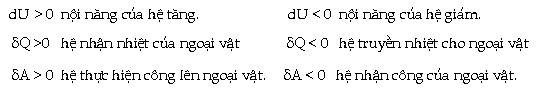
| V.
NHIỆT DUNG RIÊNG CỦA KHÍ LÝ TƯỞNG.
|

|
Nhiệt
dung riêng của một chất bất kỳ là
một đại lượng vật lý có giá
trị bằng nhiệt lượng cần cung
cấp cho một đơn vị khối lượng
chất đó để làm tăng nhiệt độ
thêm 1o.
Để
thuận tiện trong việc tính toán người
ta còn đưa thêm khái niệm nhiệt dung
riêng phân tử. Nhiệt
dung riêng phân tử của một chất bất
kỳ là một đại lượng vật lý
có giá trị bằng nhiệt lượng cần
cung cấp cho
một kmol chất ấy để làm tăng
nhiều độ lên 1o.
Ký
hiệu nhiệt dung riêng là c, nhiệt dung riêng phân
tử là C, rõ ràng ta có:

Ðối
với chất khí ta cần phân biệt xem ta làm
nóng chất khí trong điều kiện nào: đẳng
tích hay đẳng áp. Do đó ta có nhiệt dung
riêng đẳng tích và nhiệt dung riêng đẳng
áp.
|
1. Nhiệt dung riêng đẳng tích.
|

|
Theo
định nghĩa, nhiệt dung riêng phân tử
đẳng tích được viết dưới
dạng:
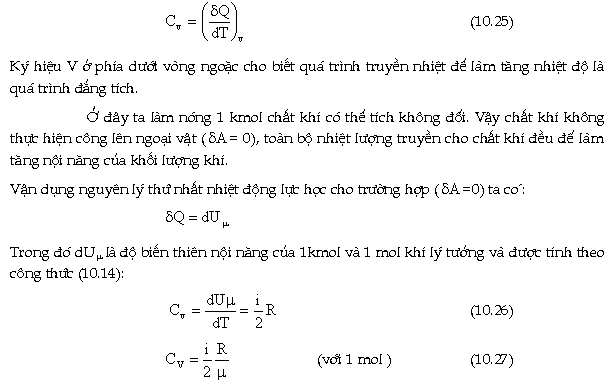
|
2. Nhiệt dung riêng của đẳng áp.
|

|
Theo
định nghĩa, nhiệt dung riêng phân tử
đẳng áp được viết dưới
dạng:

Ký
hiệu p ở phía dưới vòng ngoặc
chỉ rằng quá trình truyền nhiệt để
làm tăng nhiệt độ là quá trình đẳng
áp.
Ðể
giữ cho áp suất không đổi thì khi bị
đun nóng chất khí phải dãn ra nghĩa là
phải tăng thể tích, ở đây nhiệt
lượng truyền cho chất khí được
dùng để làm tăng nội năng của khí
và ngay sau đó vì để giữ cho áp suất
không đổi nên một phần nội năng
đã được dùng để sinh công
thắng ngoại lực để tăng
thể tích của khí.
Vận
dụng nguyên lý thứ nhất nhiệt động
lực học cho trường hợp này ta có:
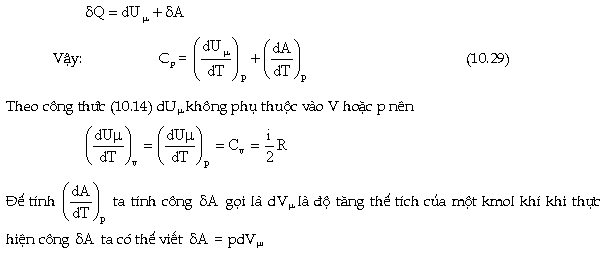
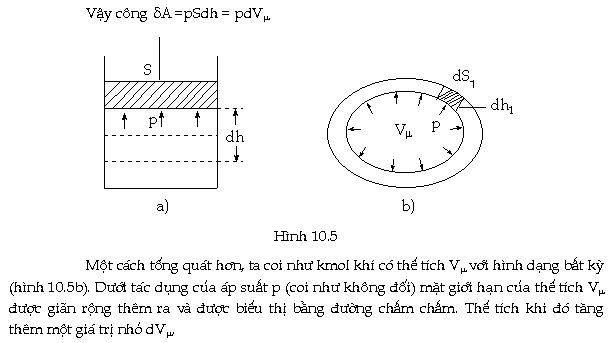
Để
chứng minh điều này ta tưởng tượng
một KMOL khí chứa trong xylanh phía
trên có pit-tông (Hình 10.5a) Dưới tác dụng
của áp suất p của chất khí (coi như
không đổi) khi đun nóng khí, pit-tông đã
chuyển lên phía trên một đoạn dh.
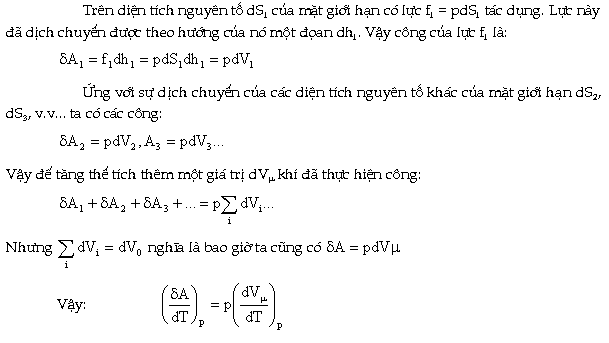
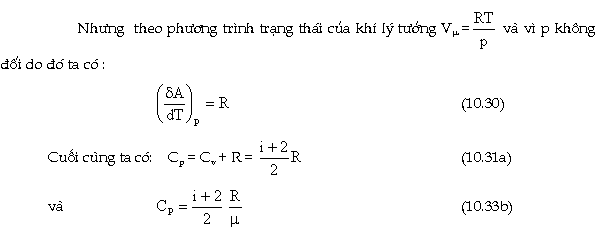
Từ
công thức (10.30) ta thấy, hằng số chung
của chất khí R có giá trị bằng công
thực hiện bởi một kmol khí lý tưởng
khi nó dãn ra trong quá trình đun nóng đẳng áp
để làm tăng
nhiệt độ thêm 1o.
|
3 Tỉ số giữa nhiệt dung riêng
đẳng áp và đẳng tích.
|

|
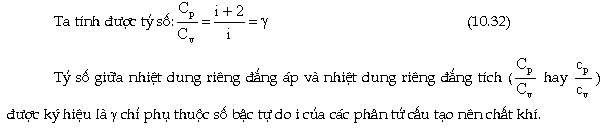
|
4.
Ðơn vị đo nhiệt dung riêng.
|
|
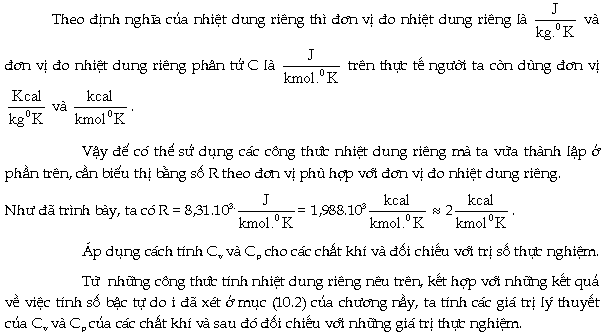
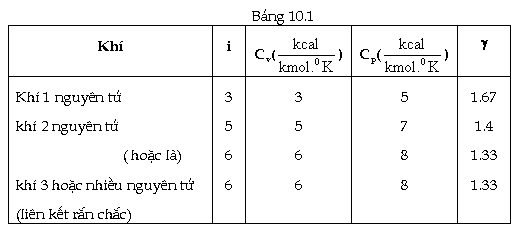
Những
kết quả tính nhiệt dung riêng phân tử
theo lý thuyết cho một số chất khí đã
được ghi trên bảng (10.1)
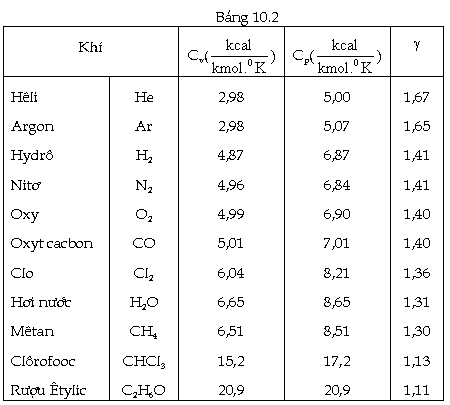
Giá
trị thực nghiệm của nhiệt dung riêng
phân tử của một số chất khí
được ghi trên bảng (10.2)
Ðối
chiếu giá trị lý thuyết với gía trị
thực nghiệm, ta có được những
nhận xét sau:

Thuyết
nhiệt dung riêng được trình bày trên
đây gọi là thuyết nhiệt dung riêng
cổ điển. Nó chỉ ứng dụng
được trong một phạm vi nhất định.
Thiếu sót chủ yếu của thuyết này là:
1-
Không giải thích được sự sai
lệch giữa các trị số lý thuyết và
thực nghiệm của nhiệt dung riêng mặc
dù sự sai lệch này không lớn nhưng
vẫn vượt quá sai số thực nghiệm
và là một sai lệch có thực.
2-
Không giải thích được một cách đầy
đủ và rõ ràng những giá trị thực
nghiệm lớn của nhiệt dung riêng các khí mà
phân tử có số nguyên tử lớn hơn 3.

|