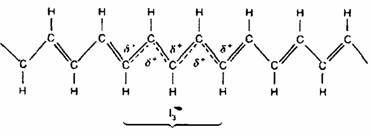
|
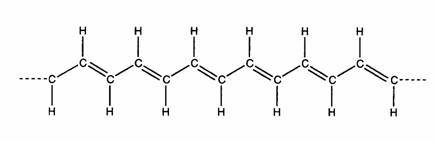
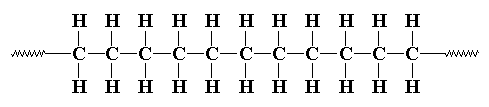
Lời giới thiệu: Để kỷ niệm 30 năm ngày phát hiện polymer (plastic) dẫn điện tại Tokyo Institute of Technology (Đại học Công nghiệp Đông kinh, Nhật Bản), mà đỉnh cao là giải Nobel Hóa học (năm 2000) được trao cho các giáo sư MacDiarmid, Heeger và Shirakawa, người viết đã mạo muội phổ biến một loạt bài về các ứng dụng của polymer dẫn điện. Bài viết mang tính chất áp dụng lúc nào cũng cho nhiều màu sắc lóng lánh, tràn đầy một niềm hy vọng cho tương lai hơn là những bài viết lý thuyết khô khan. Nhưng khi nhìn lại, người viết cảm thấy mình đã đặt "chiếc cày trước mũi con trâu", nói nhiều áp dụng nhưng ít thông tin về các đặc tính và lý thuyết cơ bản của polymer dẫn điện/polymer mang nối liên hợp. Chặng đường 30 năm khá dài và vật liệu nầy đã nghiễm nhiên trở thành một bộ môn riêng biệt trong nghiên cứu khoa học. Thiển nghĩ, lý thuyết dù khô khan nhưng tầm quan trọng của bộ môn nầy chắc cũng không làm phí thì giờ người đọc. Bài viết sau đây là để bổ sung các bài viết trước về mặt lý thuyết. Người viết hy vọng nó sẽ không khô như mái ngói mùa hè và thích hợp cho trình độ năm cuối trung học phổ thông và hai năm đầu đại học. Nếu những mục tiêu nầy không đạt, xin độc giả lượng thứ. 1. Dẫn nhậpCơ chế dẫn điện của polymer dẫn điện là một khái niệm mới. Nó không tuân theo cơ chế cổ điển của kim loại. Nhưng dù là khái niệm mới hay cơ chế cũ, cách lý giải những hiện tượng dẫn điện vẫn phải dựa vào một nền tảng chung và thống nhất. Đó là những kiến thức cơ bản trong hóa lý, về vân đạo nguyên tử, vân đạo phân tử, các loại liên kết hóa học (chemical bonding) giữa các nguyên tố và các mực năng lượng điện tử được thành hình trong quá trình kết hợp. Cốt lõi của những kiến thức nầy là các khái niệm trong vật lý chất rắn và cơ học lượng tử. Giải thích một khái niệm mới bằng một ngôn ngữ giản dị không dễ, nhưng nếu dùng những khái niệm đã biết để dẫn đến khái niệm chưa biết có lẽ sẽ làm người đọc thoải mái hơn. Bài viết nầy được viết theo chiều hướng đó. 2. Điện tử p trong nối liên hợpNối đôi của polyacetylene (PA) (Hình 1) biểu hiện sự khác biệt cấu trúc phân tử giữa polyethylene (PE) (Hình 2) và PA. Các nối trong PE là liên kết cộng hóa trị do sự tạp chủng giữa 1 vân đạo s và 3 vân đạo p (= 4 vân đạo tạp chủng sp3) cho ra 4 nối s (sigma) rất bền xung quanh nguyên tố carbon (2 nối C - H, 2 nối C - C), điện tử của nối s được gọi là điện tử s [1]. Trong PA, do tạp chủng giữa 1 vân đạo s và 2 vân đạo p (= 3 vân đạo tạp chủng sp2) cho ra 3 nối s (1 nối C - H, 2 nối C - C) và 1 nối p (pi) do của vân đạo pz của hai nguyên tố kề nhau tạo thành. Vì vậy, thực chất của nối đôi C = C là do 1 nối s và 1 nối p.
Hình 1: Cấu trúc polyacetylene
Hình 2: Cấu trúc polyethylene
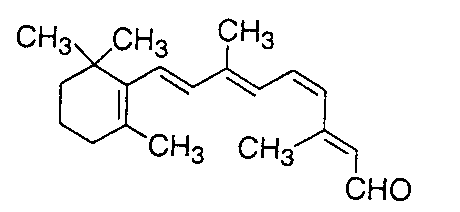
Liên kết p không bền, có nghĩa là điện tử p có nhiều hoạt tính hóa học, sẵn sàng phản ứng nếu có điều kiện thích hợp. Điện tử p, nhất là điện tử p trong các nối liên hợp (nối đơn và nối đôi tuần tự thay nhau, - C = C - C = C –) cho nhiều hiện tượng và áp dụng thú vị. Vì không bền nên chỉ cần một năng lượng nhỏ cũng đủ kích hoạt điện tử p sang một trạng thái khác. Ngay trong sinh vật và thực vật, điện tử p cho nhiều biến đổi kỳ diệu. Mắt của các sinh vật kể cả con người có một loại enzyme gọi là retinene ở võng mạc của mắt. Retinene có cấu trúc nối liên hợp - C = C - C = C – (Hình 3). Điện tử p của retinene chỉ cần năng lượng nhỏ như năng lượng ánh sáng là có thể biến chuyển hình dạng phân tử retinene, trạng thái điện tử và điện tính của retinene, gây ra một tín hiệu truyền đến não bộ và làm cho ta thấy được.
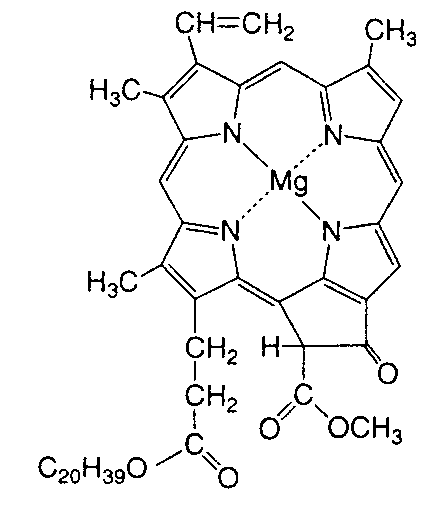
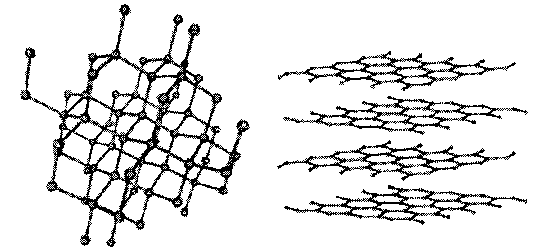
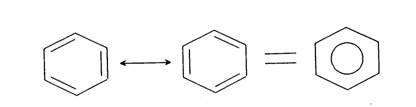
(b) Hình 3: Cấu trúc (a) retinene và (b) chlorophyll Thực vật có diệp lục tố (chlorophyll), cho ta màu xanh của lá. Cấu trúc của diệp lục tố cũng là một cấu trúc nối liên hợp (Hình 3). Dưới ánh sáng mặt trời các điện tử p được kích hoạt để hiện tượng quang hợp xảy ra. Diệp lục tố trở thành một chất xúc tác biến khí CO2 và nước trong không khí thành đường glucose và thải ra oxygen. Glucose là nguồn năng lượng chính của thực vật. Glucose có thể trùng hợp để biến thành tinh bột trong trái cây, các loại củ và ngũ cốc. Ngoài ra, heme trong hồng huyết cầu là phân tử vòng có nối liên hợp và chứa nguyên tố sắt. Chức năng của heme là tải oxygen để nuôi dưỡng các tế bào. Có thể nói rằng nối liên hợp một cách gián tiếp đóng một vai trò cực kỳ quan trọng để duy trì sự sống của toàn thể thực vật và sinh vật trên quả địa cầu. Chất dẫn điện và chất cách điện khác nhau ở chỗ dòng điện có thể truyền qua vật chất đó được hay không. Vật chất là tập hợp của nhiều nguyên tử. Sự truyền điện của vật chất tùy thuộc vào bản chất và cách liên kết của các nguyên tử. Kim loại được liên kết tạo ra những điện tử tự do. Những điện tử nầy là phần tử tải điện (charge carrier). Khi có điện áp, điện tử di động và dòng điện xuất hiện. Vì một lý do nào đó những điện tử không còn di động được nữa thì dòng điện biến mất. Dòng chảy của phần tử tải điện (trong trường hợp kim loại là điện tử) như là dòng nước. Khi nước bị đóng băng ta không có dòng nước. Khi băng tan, dòng nước xuất hiện. Một thí dụ về sự di động tự do của điện tử là sự khác biệt về đặc tính dẫn điện giữa than chì (graphite) và kim cương. Cùng được tạo thành từ nguyên tố carbon, than chì là vật dẫn điện nhưng kim cương là vật cách điện tuyệt vời. Than chì được dùng làm lõi bút chì, rất mềm và rẻ tiền. Kim cương là đá quí có độ cứng cao nhất trong các vật liệu, được dùng làm đồ trang sức cho các bậc mệnh phụ từ khi con người biết làm đẹp. Nếu ta dùng một điện trở kế đặt vào hai đầu bút chì thì ta sẽ đo được điện trở trong khoảng 10 – 50 Ω (Ohm). Điện trở than chì cao hơn kim loại nhưng vẫn là vật dẫn điện tốt (điện trở càng thấp thì độ dẫn điện càng cao). Để hiểu rõ sự khác biệt một trời một vực điện tính giữa than chì và kim cương, ta hãy quan sát cấu trúc của hai vật liệu nầy. Than chì là một tập hợp của nhân benzene liên kết thành những mảng hình tổ ong chồng chập lên nhau (Hình 4). Các sách hóa hữu cơ đều cho biết một điều cơ bản là điện tử p di động tự do trong nhân benzene do sự chuyển vị (delocalization) gây ra bởi hiệu ứng cộng hưởng. Ta không còn phân biệt được nối đơn hay nối đôi vì điện tử p di chuyển tự do và phân bố đều trong nhân (Hình 5). Trạng thái nầy là trạng thái bền nhất của benzene vì ở năng lượng thấp nhất. Khi các nhân benzene kết hợp lại tạo thành những mảng tổ ong của than chì, các điện tử p tạo thành những "đám mây" dải rộng, di chuyển tự do trên mặt phẳng của tổ ong. Những điện tử tự do nầy, giống như kim loại, là nguyên nhân của sự dẫn điện trong than chì. Ngược lại, trong kim cương những tổ ong nầy được liên kết bằng những nối tạo ra một tinh thể 3 chiều (Hình 4), ta không còn những đám mây điện tử di động tự do. Vì "dòng sông" điện tử bây giờ đã bị đóng băng, kim cương là vật cách điện.
(a) (b)
Hình 5: Hiệu ứng cộng hưởng của nhân benzene
3. Dải năng lượng điện tử
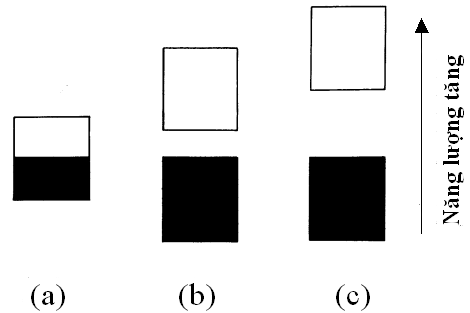
Lối giải thích "dòng sông" điện tử lúc chảy, lúc bị "đóng băng" chỉ mang tính chất định tính để người đọc có thể hình dung được cơ chế dẫn điện và cách điện. Giải thích mang tính định lượng của cơ chế nầy đòi hỏi sự lý giải cấu trúc điện tử dựa trên sự thành hình của các mức năng lượng điện tử trong quá trình nguyên tử kết hợp thành phân tử, phân tử kết hợp thành vật liệu. Việc nầy đòi hỏi một kiến thức cơ bản về vật lý chất rắn và cơ học lượng tử. Nói một cách đơn giản, điện tính của tất cả mọi vật liệu được quyết định bởi cấu trúc điện tử của vật liệu đó. Và cấu trúc điện tử có thể được giải thích rành mạch theo quan điểm "dải năng lượng điện tử" (electronic energy band). Vật liệu được khảo sát ở đây là thể rắn. Ở thể rắn, các vân đạo nguyên tử liên kết, chồng chập lên nhau ở mọi phương hướng để tạo nên vân đạo phân tử. Trong trường hợp đơn giản nhất, khi hai nguyên tử kết hợp với nhau cho hai vân đạo phân tử. Các điện tử của hai nguyên tử bây giờ trở thành điện tử của phân tử và các điện tử nầy chỉ được phép ở những mức năng lượng nhất định. Cơ học lượng tử giúp ta tính toán những giá trị của mức năng lượng. Chất rắn được tạo thành do sự chồng chập của các tập hợp nguyên tử. Người ta phỏng tính 1 cm3 chất rắn được 1022 (22 số 0 sau số 1, hay là 10 ngàn tỷ tỷ) nguyên tử tạo thành. Trong quá trình nầy, theo cơ học lượng tử, những mực năng lượng điện tử sẽ được thành hình và các điện tử sẽ chiếm cứ các mực năng lượng nầy. Như vậy, ta có 1022 vân đạo phân tử và 1022 mức năng lượng tương ứng được tạo thành. Các mức năng lượng nầy chồng chập lên nhau theo thứ tự trị số của chúng, trở thành dải được gọi là "dải năng lượng điện tử". Dải ở năng lượng thấp gọi là dải hóa trị (valence band) và dải ở năng lượng cao hơn gọi là dải dẫn điện (conduction band) (Hình 6). Vì con số 1022 là một con số rất lớn, những mức năng lượng chồng chập nhau trông giống như một dải liên tục. Như bề dày của một quyển tự điển, từ xa nhìn thì trông như một khối liên tục, nhìn gần thì mới thấy những trang giấy rời rạc.
Hình 6: Dải năng lượng điện tử: (a) kim loại, (b) chất bán dẫn, (c) chất cách điện. Dải đen tượng trưng cho dải hóa trị và dải trắng cho dải dẫn điện. Khe dải là khoảng cách giữa dải đen và dải trắng. Sự thành hình dải năng lượng của chất rắn có thể không liên tục, khi đó sẽ có một "khoảng trống" xuất hiện, giống như cái mương chia ra hai dải (miền) năng lượng. Khoảng trống đó gọi là khe dải năng lượng (energy band gap) (Hình 6). Như ta sẽ thấy ở phần sau, khe dải không phải là một khái niệm trừu tượng mà là một thực thể có thể kiểm chứng bằng thí nghiệm. Trị số khe dải được tính bằng electron volt (eV) [2]. Khe dải quyết định sự dẫn điện hay không dẫn điện của chất rắn. Sự dẫn điện hay không dẫn điện là do khả năng "nhảy mương" của các điện tử. Nếu điện tử của chất rắn không thể nhảy từ miền năng lượng thấp lên miền năng lượng cao, ta có vật cách điện. Những vật liệu kết hợp bằng nối s như polyethylene hay kim cương có khe dải lớn hơn 8 eV; cái "mương" quá rộng để điện tử có thể nhảy qua trong điều kiện bình thường (nhiệt độ 22 °C, áp suất 1 atm). Đây là những vật cách điện tuyệt vời. Ngược lại, khe dải của kim loại là zero. Khe dải zero có nghĩa dải hóa trị và dải dẫn điện tiếp cận hoặc đan vào nhau. Nhờ đó các điện tử không cần phải "nhảy mương" mà chỉ di chuyển qua lại thoải mái, nên sự dẫn điện xảy ra một cách tự nhiên. Than chì có khe dải rất hẹp giống như kim loại. Ở giữa hai cực đoan nầy là chất bán dẫn (thí dụ: silicon). Khe dải các chất bán dẫn nằm trong khoảng 1 - 1,5 eV. Trong điều kiện bình thường, một số các điện tử có thể nhảy lên mức năng lượng cao hơn nhờ nhiệt năng (thermal energy) chiếm cứ dải dẫn điện. Vì vậy, hiện tượng bán dẫn xảy ra. Khe dải năng lượng là một đặc tính vô cùng quan trọng của vật chất không những cho điện tính (cách điện, dẫn điện hay bán dẫn), mà còn trong việc thiết kế một vật liệu trong những áp dụng quang học, hay quang điện tử (optoelectronics) mà sự phát quang là một thí dụ điển hình. Hai điều kiện cần cho sự dẫn điện trong polymer dẫn điện là (1) nối liên hợp và (2) dopant [3]. Chỉ có nối liên hợp thì chưa đủ. Nếu không có dopant, khe dải của các polymer tiêu biểu có nối liên hợp như polyacetylene (PA), poly(3,4-ethylenedioxythiophene) (PEDOT), polypyrrole (PPy), polyaniline (PAn), polythiophene (PT), polyphenylenevinylene (PPV) có giá trị từ 1,4 đến 3,6 eV (Bảng 1). Đây là giá trị của những chất cách điện; cùng lắm thì chỉ là chất bán dẫn hạng bét...
Bảng 1: Trị số khe dải của các polymer dẫn điện tiêu biểu
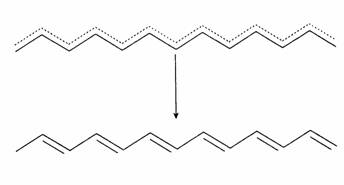
Theo sự suy nghỉ thông thường dựa trên hiệu ứng cộng hưởng hay là sự chuyển vị trong nhân benzene (Hình 5), có một lúc các nhà hóa học hữu cơ tin rằng trong polymer mang nối liên hợp các điện tử p cũng sẽ di chuyển tự do dọc theo mạch phân tử. Ta không còn phân biệt được nối đơn hay nối đôi và con người sẽ có sợi dây dẫn điện giống như kim loại ở thang phân tử. Nếu điều nầy phản ảnh một sự thật khách quan thì dây dẫn điện ở độ vi mô phân tử quả là một vật liệu trên cả tuyệt vời! Tập hợp những sợi dây nầy sẽ cho ta một chất hữu cơ dẫn điện hay ít nhất bán dẫn. Tiếc thay, sự thật lắm lúc rất phủ phàng và khắc nghiệt. Tạo hóa rất khó tính đối với con người; những phương pháp tính toán trong vật lý chất rắn và các kết quả thí nghiệm cho biết rằng thực tế không như vậy bởi vì mô hình chuyển vị điện tử p trong nhân benzene (hai thứ nguyên) không thể áp dụng cho mạch phân tử đường thẳng của polymer (một thứ nguyên). Thật vậy, theo nhà vật lý Peierls, nối liên hợp của mạch phân tử đường thẳng chỉ có thể ở trạng thái bền có năng lượng thấp nhất khi các điện tử p được định vị (localization). Có nghĩa là nối liên hợp muốn giữ cái nguyên trạng tuần tự của "nối đơn - nối đôi" cố hữu. Chỉ ở cấu trúc nầy điện tử mới có thể đạt đến năng lượng thấp nhất. Cũng xin nói thêm ở đây, mọi vật trong vũ trụ đều có khuynh hướng đi đến năng lượng thấp nhất vì đó là trạng thái bền nhất. Trạng thái chuyển hoán từ chuyển vị đến định vị gọi là "chuyển hoá Peierls" (Peierls transition) (Hình 7).
Hình 7: Chuyển hoá Peierls.
Nếu ta nhìn một cách phiến diện theo quan điểm cơ học, vì nối đơn dài hơn nối đôi, nối liên hợp có tuần tự "nối đơn - nối đôi" cho một hình dạng cũn cỡn, so le tạo ra sự "căng" trong mạch polymer. Sự căng lại gây ra một năng lượng đưa toàn bộ mạch lên một mức năng lượng cao hơn và vì vậy kém bền hơn mạch có những nối cùng một độ dài. Như vậy thì có khác gì nhân benzene với hiệu ứng cộng hưởng? Nhưng ta chớ vội mừng! Trên quan điểm năng lượng điện tử, như Peierls đã diễn giải một chuỗi có tuần tự "nối đơn - nối đôi" sẽ cho năng lượng điện tử thấp. Tổng cộng của hai loại năng lượng (cơ học và điện tử) nầy cho thấy toàn thể năng lượng của mạch phân tử có tuần tự "nối đơn - nối đôi" vẫn còn thấp hơn mạch phân tử có nối cùng một độ dài do sự chuyển vị của điện tử p. Rõ ràng là polymer mang nối liên hợp chỉ có thể ở trạng thái định vị và do đó là một chất cách điện hay là một chất bán dẫn tồi. Chuyển hoá Peierls là một hiện tượng đặc thù của mạch phân tử polymer đường thẳng, ngược lại với hiệu ứng cộng hưởng trong nhân benzene. Như vậy, "dòng sông" điện tử p của mạch nối liên hợp bị "đóng băng". Những điện tử p khi định vị đương nhiên sẽ mất đi tính di động. Tuy nhiên những "dòng băng" sẽ biến thành "dòng sông" khi nhiệt độ gia tăng, vì nhiệt năng đủ để kích động một số điện tử "nhảy sào" qua một khe dải rất cao; chuyển hoá Peierls sẽ bị đảo lộn, đi ngược từ trạng thái định vị đến trạng thái chuyển vị, lúc đó dòng điện xuất hiện. Hiện tượng nầy đã được quan sát khi đun nóng kim cương, nhưng thí nghiệm tương tự không thể thực hiện cho polymer vì ở nhiệt độ cao polymer sẽ bị phân hủy. Có lẽ do ảnh hưởng quá nặng nề của nhân benzene, các nhà hóa học đã phải trải qua một thời gian dài và nhờ vào những lý luận vật lý sắc bén để có thể phân biệt sự khác nhau của nối p trong cầu trúc vòng và cấu trúc thẳng. Ở điểm nầy, ngoài Peierls chúng ta phải tôn vinh nhà vật lý Heeger (một trong ba người đoạt giải Nobel Hóa học năm 2000) đã có những đóng góp rất lớn trong lĩnh vực lý thuyết về năng lượng điện tử của nối liên hợp.
4. Các chất dopantPhương pháp tăng nhiệt độ để "lật ngược" chuyển hoá Peierls biến chất cách điện thành dẫn điện không phải là cách làm thực tế. Câu chuyện về polymer dẫn điện xem chừng như phải chấm dứt ở đây, nếu không có sự hiện hữu của dopant. Phương pháp doping của MacDiarmid, Heeger và Shirakawa khi cho PA tiếp xúc với khí iodine làm tăng độ dẫn điện hơn 1 tỷ (109) lần là một bước đột phá mang tính lịch sử và cũng là nền tảng trong việc nghiên cứu cơ bản và áp dụng thực tế của polymer dẫn điện. Bước nhảy của độ dẫn điện từ 1 tỷ đến 10 tỷ lần không phải chỉ xảy ra ở PA mà còn thấy được ở PPy, PAn, PT và những polymer khác có nối liên hợp mà đơn vị monomer là phân tử chứa nhân benzene hoặc có cấu trúc vòng mang nguyên tố sulphur (S) hay nitrogen (N) [3]. Các nhà nghiên cứu cảm nhận ngay cơ chế dẫn điện sẽ rất khác với cơ chế thường thấy trong kim loại hay than chì, nhất là bản chất của phần tử tải điện. Vì sự "đóng băng" hay trạng thái định vị của điện tử p, phần tử tải điện trong polymer dẫn điện chắc chắn không phải là các điện tử p tự do. Bản chất của phần tử tải điện trong polymer dẫn điện nhanh chóng thu hút được sự chú ý của các nhà vật lý lý thuyết. Mặc dù PA không có giá trị trong các ứng dụng thực tiễn do sự lão hóa và tự suy thoái đưa đến việc giảm thiểu độ dẫn điện, PA với cấu trúc mạch phân tử đơn giản nhất trong các polymer có nối liên hợp, đã là một polymer được khảo sát nhiều nhất cho việc phát triển lý thuyết dẫn điện. Khi PA được tiếp xúc với một chất oxít hóa (oxidizing agent) A, PA và A sẽ kết hợp theo một phản ứng hóa học đơn giản, PA + A D (PA)+A- (1) PA trung tính, không dẫn điện. (PA)+A- là polymer dẫn điện. Các nhà vật lý gọi phản ứng nầy là quá trình doping của PA với A, hay là PA được "dope" với dopant A. Các nhà hóa học có thuật ngữ khác, gọi đây là phản ứng oxit hóa của PA vì PA mất đi điện tử cho ra (PA)+, điện tử được nhận bởi A cho ra anion (ion âm) A-. A còn được gọi là chất nhận điện tử (electron acceptor). PA+ và A- được nối kết với nhau bằng nối ion do điện tích (+) và (-). Ngược lại, khi PA được tiếp xúc với chất khử D (reducing agent), phản ứng khử PA sau đây xảy ra, PA + D D (PA)-D+ (2) Trong trường hợp nầy, PA bị khử vì PA nhận điện tử biến thành (PA)- và D cho điện tử trở thành cation (ion dương) D+. D được gọi là chất cho điện tử (electron donor). Phản ứng (1) và (2) chỉ mang tính tượng trưng cho dễ hiểu. Trong trường hợp phản ứng PA giữa khí iodine I2 như MacDiarmid, Heeger và Shirakawa đã thực hiện vào năm 1977, phản ứng phải được viết một cách chính xác như sau, [CH]n + 3/2nmI2 D [CHm+(I3)m-]n (3) Ở đây, n là số đơn vị mononer của toàn thể polymer. Trong trường hợp của PA đơn vị là [CH]; m là số đơn vị chịu ảnh hưởng của anion (I3)-. Thí dụ, nếu 1 anion (I3)- ảnh hưởng đến 5 đơn vị [CH], m = 1/5 (Hình 8) [4].
Hình 8: Kết hợp giữa PA và iodine. Hình vẽ cho thí dụ anion (I3)- gây ra điện tích dương trên 5 đơn vị (CH). Nếu anion (I3)- làm được việc thì các anion khác cũng sẽ cho một hiệu quả tương tự. Vài năm sau, nhóm MacDiarmid và Heeger làm thí nghiệm với anion perchlorate (ClO4-). Để PA kết hợp với anion nầy, phim PA được nhúng vào một dung dịch có anion ClO4- (chẳng hạn như muối LiClO4 trong một dung môi thích hợp sẽ cho Li+ và ClO4-). Anion nầy sẽ kết hợp bằng phương pháp điện hóa theo phản ứng, [CH]n + nm(ClO4-) D [CHm+(ClO4-)m]n (4) Một thí dụ của phản ứng (2) là nhúng phim PA trong một dung dịch khử chứa cation của sodium, Na+ (thí dụ: dung dịch sodium naphthalide), [CH]n + nm(Na+) D [CHm-(Na+)m]n (5) Trên thực tế, người ta thường dùng phản ứng (1) để tạo ra polymer dẫn điện vì phương pháp nầy dễ thực hiện hơn phản ứng (2). Điều đáng chú ý trong các phản ứng trên là ký hiệu thuận nghịch (D) [5]. Ký hiệu nầy cho biết phản ứng có thể đi từ trái sang phải và cũng đi từ phải sang trái. Sự thuận nghịch cho biết ta có thể điều chỉnh độ dẫn điện của một vật liệu; biến một vật cách điện thành dẫn điện và ngược lại. Phản ứng từ trái sang phải, như đã đề cập bên trên, là quá trình doping trong đó polymer cách điện kết hợp với dopant cho ra chất dẫn điện polymer/dopant. Phản ứng từ phải sang trái là quá trình dedoping trong đó polymer/dopant bị tách rời trả lại polymer cách điện nguyên thủy. Hai phản ứng nầy được thực hiện một cách dễ dàng trong phòng thí nghiệm nhưng lại là một đề tài nghiên cứu nhiều thử thách dưới một cái tên chung "chuyển hoán giữa vật cách điện và kim loại" (insulator - metal transition) của các nhà vật lý chất rắn. Sự thuận nghịch nầy chỉ ra một hướng đi thực tiễn với một tiềm năng áp dụng rất linh động trong dạng vật liệu thông minh. Đặc tính nầy đưa đến những áp dụng trong thực tế đã được bàn kỹ trong những bài viết trước. Ngoài khí iodine, các loại khí trong họ halogen như khí chlorine (Cl2), bromine (Br2) đều có tác dụng tăng độ dẫn điện. Ngoài PA, nhiều loại polymer dẫn điện khác trong đó có polyaniline (PAn), polypyrrole (PPy), polythiophene (PT), polyalkylthiophene (chất dẫn xuất (derivatives) của PT), đặc biệt là poly(ethylenedioxythiophene) (PEDOT) đã được khảo sát. Tương tự như PA, khi PT được kết hợp với khí iodine độ dẫn điện tăng đến 10 tỷ lần. Trong bài viết nầy chúng ta chỉ đề cập đến chất nhận điện tử là dopant để cho ra anion (quá trình doping theo phản ứng (1)). Bảng 2 cho thấy những dopant tiêu biểu bao gồm các phân tử, các hợp chất và các phân tử sinh học. Bảng 2: Các loại dopant, A, nhận điện tử cho ra anion A- (A + e- ® A-)
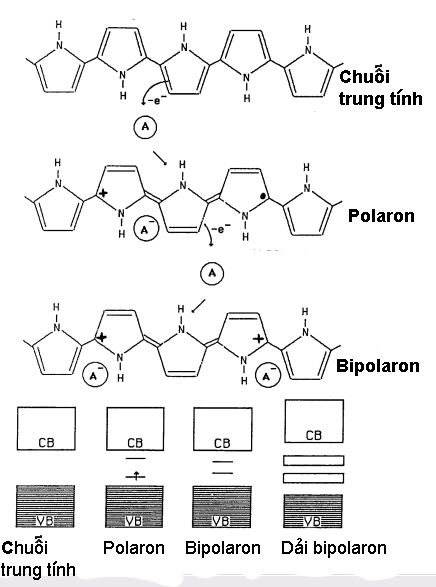
Bảng 2 cho ta thấy sự chọn lựa dopant cho những polymer nối liên hợp rất phong phú. Dopant có thể là một phân tử, một hợp chất vô cơ, hữu cơ, thậm chí có thể là một polymer hay phân tử sinh học như enzyme. Ngoài yếu tố gây nên sự dẫn điện trong polymer có nối liên hợp, dopant có một vai trò quan trọng trong việc định đoạt sự cao thấp của độ dẫn điện, vật tính (physical properties), cơ tính (mechanical properties), độ bền môi trường (environmental stability) và độ bền nhiệt (thermal stability). Điều nầy hiển nhiên vì dopant trong polymer có thể đạt đến 50 % trọng lượng, nên sự chi phối của dopant rất lớn. 5. Polaron và BipolaronSau cuộc chạy đua nâng cao độ dẫn điện của PA trong thập niên 80 của thế kỷ trước, các nhà nghiên cứu nhận thấy đây chẳng qua là một cuộc chơi hàn lâm. Trên thực tế, độ dẫn điện trung bình ở mực của các chất bán dẫn (từ 0,1 đến 100 S/cm) là vừa đủ cho các ứng dụng. Tuy nhiên cũng nhờ cuộc chạy đua nầy các nhà khoa học đã khám phá rất nhiều "bí ẩn" của cơ chế dẫn điện trong polymer dẫn điện. Tất cả bí ẩn chỉ nằm gọn trong một câu hỏi cơ bản: Tại sao khi có sự hiện diện của dopant thì polymer mang nối liên hợp chuyển từ trạng thái cách điện sang dẫn điện? Ta hãy khảo sát sự liên hệ giữa quá trình doping và sự biến đổi của dải năng lượng của polypyrrole (PPy) (Hình 9). Pyrrole là một phân tử vòng năm góc chứa một nguyên tố nitrogen (N). Trước quá trình doping (hay bị oxit hóa), PPy có khe dải là 3,2 - 3,6 eV. Trị số nầy cho ta biết đây là một chất cách điện tiêu biểu. Quá trình doping PPy với dopant, A, được biểu hiện trong Hình 9. Khi PPy được tiếp cận với A, PPy sẽ mất một điện tử p, e-, cho A (mất điện tử có nghĩa là bị oxit hóa). Kết quả là trên mạch phân tử của PPy, ta có một lỗ trống mang điện tích dương (+) do sự mất đi của một điện tử [6] và một điện tử p đơn lẻ còn lại được ký hiệu là một chấm (·); A nhận e- trở thành A- [7]. Cặp (+ ·) được gọi là polaron trong vật lý học. Cặp nầy thường cách nhau 3 hoặc 4 đơn vị pyrrole. Trong Hình 9, (+) cách (·) 3 đơn vị. Sự thành hình của polaron làm thay đổi vị trí của các nối p còn lại làm thay đổi cấu trúc của vòng pyrrole và đồng thời tạo ra hai bậc năng lượng mới trong khe dải.
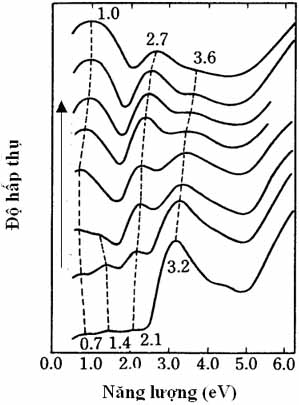
Hình 9: Polaron, bipolaron và sự hình thành của các dải năng lượng tương ứng. CB: Conduction band (dải dẫn điện), VB: Valence band (dải hóa trị) [8]. Khi dopant được sử dụng ở nồng độ cao, "dân số" A gia tăng cho nên A có khả năng nhận thêm điện tử từ PPy. Polaron (+ ·) cũng gia tăng. Khi hai polaron gần nhau (+ ·) (+ ·), hai điện tử (· ·) trở thành nối p, còn lại cặp điện tích dương (+ +) được gọi là bipolaron (Hình 9). Ở nồng độ cao hơn nữa, mạch PPy xuất hiện càng nhiều bipolaron, các bậc năng lượng hình thành bởi sự hiện diện của bipolaron sẽ hòa vào nhau thành hai dải năng lượng bipolaron. Các kết quả thực nghiệm đã chứng minh rằng polaron và bipolaron là phần tử tải điện của polymer dẫn điện. Tương tự như điện tử tự do trong kim loại hay than chì, khi có một điện áp polaron hay bipolaron sẽ di động. Nói một cách khác, polaron và bipolaron là nguyên nhân của dòng điện trong polymer. Ở nồng độ dopant thấp, khi chỉ có một số ít dopant được kết hợp với mạch polymer, polaron là phần tử tải điện. Khi nồng độ gia tăng, bipolaron là phần tử tải điện. Các bậc năng lượng mới thành hình, tồn tại như hai bậc thang giúp điện tử di chuyến từ dải hóa trị đến dải dẫn điện ở bậc cao hơn mà không phải tốn nhiều công sức. Sự dẫn điện xảy ra. Brédas và các cộng sự [9] lần đầu tiên đã báo cáo phương pháp tính toán dựa trên những nguyên lý vật lý cơ bản sự hình thành của dải bipolaron và cho biết các khoảng cách của dải nầy đối với dải dẫn điện và dải hóa trị với những trị số rất chính xác rất phù hợp kết quả thực nghiệm. Những khái niệm về dải năng lượng, khe dải được trình bày ở đây đều mang tính chất trừu tượng đầy lý thuyết. Như một thông lệ trong khoa học, một lý thuyết chỉ có giá trị sau khi được chứng minh bằng thực nghiệm. Như vậy, chúng ta phải làm một thí nghiệm gì để có thể "thấy" được những dải năng lượng và dải bipolaron gây ra bởi sự kết hợp giữa dopant vào mạch polymer. Thật ra, điều nầy cũng không có gì khó khăn nếu chúng ta có một quang phổ kế. Đây là việc mà Brédas và cộng sự thực hiện vào năm 1984, 7 năm sau ngày phát hiện PA dẫn điện. Hình 10 là kết quả thực nghiệm của Brédas và cộng sự [9]. Hình nầy cho thấy đường cong hấp thụ của phim PPy được kết hợp (dope) với anion ClO4- (perchlorate) khi nồng độ của anion trong PPy tăng dần. Nguyên tắc thí nghiệm với quang phổ kế là vật liệu được khảo sát được quét với sóng điện từ với những năng lượng bức xạ khác nhau. Trục ngang của đồ thị là năng lượng bức xạ của sóng điện từ tác động vào phim PPy/ClO4-. Năng lượng được dùng trong thí nghiệm trong khoảng 0,5 đến 6 eV [10]. Đây là vùng của tia hồng ngoại, ánh sáng thấy được và tia tử ngoại. Vật liệu sẽ hấp thụ năng lượng bức xạ khi bản thân vật liệu có khoảng cách năng lượng tương ứng. Khi đó đường cong trong đồ thị xuất hiện một đỉnh cao. Khi nồng độ dopant rất thấp (đường cong dưới cùng), đường cong chỉ có một đỉnh ở 3,2 eV. Đây là khoảng cách giữa dải hóa trị và dải dẫn điện trong PPy. Khi nồng độ dopant gia tăng những đỉnh khác xuất hiện biểu hiện sự hình thành các mực và dải năng lượng tạo nên bởi sự hiện hữu của polaron, bipolaron. Tất cả đều phù hợp với sự tiên liệu của Brédas và cộng sự. Cũng theo cách tính của các tác giả, nếu mạch polymer được kết hợp với dopant 100 % (1 phân tử kết hợp với 1 phân tử đơn vị của polymer) thì dải năng lượng bipolaron sẽ tỏa rộng nối liền dải hóa trị và dải dẫn điện. Lúc đó toàn dải năng lượng giống như kim loại (Hình 6). Ta sẽ có một polymer dẫn điện như kim loại. Hiện nay, 1 dopant chỉ có thể kết hợp (dope) 3 phân tử đơn vị (tỉ lệ 1:3 hay là 33.33 %). Trên thực tế, việc chế tạo polymer với 100 % dopant chỉ là giả thuyết vượt ra ngoài khả năng tổng hợp hiện nay.
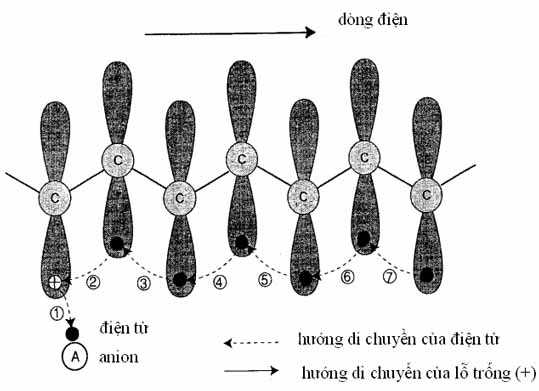
Hình 10: Đường cong hấp thụ năng lượng bức xạ của PPy/ClO4- từ quang phổ kế. Mũi tên chỉ hướng gia tăng nồng độ của ClO4- trong mạch PPy. Cơ chế dẫn điện của polymer dẫn điện có thể giải thích một cách định tính bằng hình vẽ (Hình 11). Khi dopant A nhận một điện tử từ polymer, một lỗ trống (+) xuất hiện. Khi một dòng điện được áp đặt vào polymer, điện tử p của nguyên tố C bên cạnh nhảy vào lỗ trống nầy và cứ tiếp diễn như thế. Sự di chuyển của điện tử chỉ là sự di chuyển ngắn, nhưng nhờ sự di chuyển nầy lỗ trống (+) được liên tục di động dọc theo mạch polymer. Lỗ trống nầy là một phần polaron hay bipolaron. Sự di động của lỗ trống xác nhận polaron/bipolaron là một thực thể tải điện và là nguyên nhân của sự dẫn điện giống như điện tử trong kim loại. Thực nghiệm cho thấy điện tử của polymer nầy có thể nhảy sang chiếm cứ lỗ trống của polymer kế cận rồi polymer kế cận khác... Như vậy, ta có thể hình dung lỗ trống (+) di động lan tràn khắp tất cả vật liệu theo hướng của điện áp. Hình 11 cho thấy rất rõ ràng hai yếu tố cho sự dẫn điện trong polymer là: (1) nối liên hợp và (2) dopant. Mất đi một trong hai sự dẫn điện không xảy ra.
Hình 11: Hình vẽ mô tả sự chuyển động của điện tử p (l) và lỗ trống (+). Một điện tử chiếm cứ một vân đạo pz (có dạng hình số 8) [11].
6. Lời kếtỞ đầu thập niên 60 của thế kỷ trước, khi các nhà hóa học Úc tình cờ tổng hợp một hỗn hợp chứa PPy và "chất tạp" iodine, họ không biết rằng họ đã tạo ra một polymer dẫn điện đầu tiên. Ám ảnh của sự chuyển vị các điện tử p trong nhân benzene đã khiến họ dồn sức vào việc tinh chế polymer mang nối liên hợp bằng cách loại trừ iodine với niềm hy vọng tạo ra những "sợi dây" dẫn điện cực kỳ nhỏ và dài ở thang phân tử. Nhưng càng tinh chế thì polymer mang nối liên hợp càng mất đi tính dẫn điện vì mất đi "chất tạp" dopant. Khái niệm dopant tạo ra sự dẫn điện không ngự trị trong đầu óc của các nhà hoá học đương thời và có lẽ họ cũng không biết đến sự hiện hữu của chuyển hoá Peierls. Tiếc thay, họ bỏ lửng công việc! Các nhà nghiên cứu Úc đã bỏ mất một cơ hội ngàn vàng để tạo ra một cuộc cách mạng khoa học.
Phải đợi hơn 10 năm sau khái niệm dopant trong chất bán dẫn mới được MacDiarmid, Heeger, Shirakawa áp dụng một cách linh hoạt vào polymer mang nối liên hợp, tạo ra một vật liệu và một khái niệm mới về cơ chế dẫn điện, trong đó polaron và bipolaron được xác nhận là nguyên nhân của sự dẫn điện trong polymer. Sự phát hiện thú vị nầy châm ngòi cho sự bùng nổ trong các nghiên cứu cơ bản và ứng dụng. Cho đến ngày hôm nay đúng 30 năm sau, các đề tài về polymer mang nối liên hợp nói chung, polymer dẫn điện nói riêng, vẫn còn là những đề tài nóng bỏng của các nhà khoa học trên toàn thế giới. Trên phương diện nghiên cứu cơ bản, polymer dẫn điện là một phương tiện để thấu triệt hóa học và vật lý của polymer mang nối liên hợp. Polymer dẫn điện cũng mang đến các nhà vật lý một cơ hội để giải thích những vấn đề cơ bản trong vật lý chất rắn như sự chuyển hóa giữa kim loại và vật cách điện (metal-insulator transition) và sự bất ổn định Peierls (Peierls instability). Trên phương diện áp dụng và vật liệu học, polymer dẫn điện cho những đặc tính điện học và quang học của một chất bán dẫn, nhưng vẫn giữ đặc tính cố hữu và hấp dẫn của một polymer về cơ tính, chế biến và gia công. Ngoài ra, khả năng chuyển hoán từ trạng thái cách điện sang dẫn điện và ngược lại, và khả năng hấp thụ năng lượng ở dải sóng điện từ gồm tia hồng ngoại, ánh sáng thấy được và tia tử ngoại đã cho thấy những tiềm năng áp dụng phong phú của loại vật liệu nầy. y. TVT 1 August 2007
Ghi chú và Tài liệu tham khảo
E = hn h là hằng số Planck. Tần số, n, và độ dài sóng, l, của sóng điện từ liên hệ qua công thức, c = ln c là vận tốc ánh sáng. Như vậy, E = hc/l E(eV) = 1240/l (nm) Đơn vị E là eV, l là nm (nanometer), h = 6,6256 x 10-27 erg.s; 1 eV = 1,602 x 10-12 erg, c = 300.000 km/s. 11. Nguồn: Yoshino Katsumi, "Dodensei Kobunshi no Hanashi" (tiếng Nhật) (Câu chuyện về cao phân tử dẫn điện), 2001, Nikkan Kogyo Shimbun Pub., Tokyo.
© http://vietsciences.free.fr và http://vietsciences.org Trương Văn Tân |